Acompañamos a nuestros clientes
a cumplir las normas de serialización de cada país de forma simple optimizando los procesos.
¿Cómo funciona?
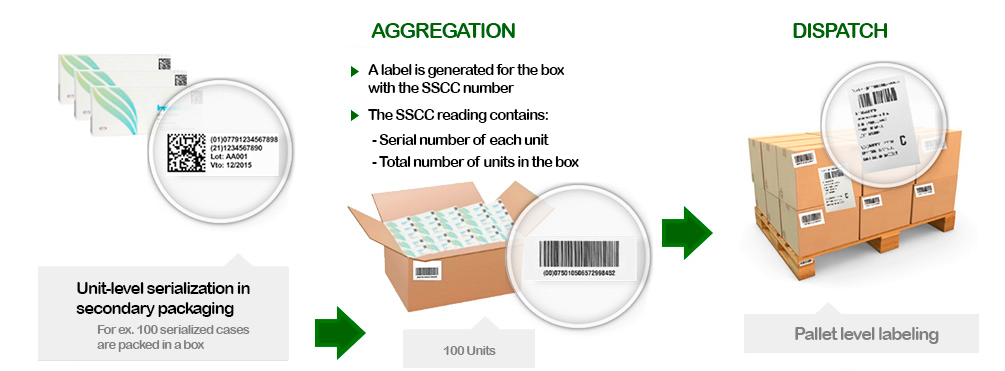
A cada una de las especialidades comercializadas se le asigna una identificación, individual y unívoca a fin de poder lograr este seguimiento con el objeto de asegurar el control de los productos y contribuir a erradicar la circulación de aquellos que sean ilegítimos. Es posible serializar el envase primario, secundario o terciario de los productos, según la reglamentación de cada país o la solución necesaria.
30%
De acuerdo con una estimación de la OMS, en los países emergentes y en desarrollo, hasta un 30% de todos los medicamentos son falsificados. Y en los países desarrollados, los medicamentos falsificados representan el 7-15% de todos los medicamentos que circulan.
35M u$s
Esto representa alrededor de 35.000 millones de dólares anuales (medicamentos falsificados) en fraudes y pérdidas tanto para los estados como para las compañías que los comercializan.
75%
Según informes, a fines del 2018 o principios del 2019, aproximadamente del 75% de los medicamentos recetados en el mundo estarán cubiertos por ley de serialización y trazabilidad.
Serialización. Codificación de trazabilidad

Datos bajo normas GS1:
(01) GTIN
(21) Número de serie
(17) Fecha de vencimiento
(10) Número de lote
Serialización y agregación
Principales beneficios
Reduce o elimina, la falsificación de productos.
Facilita los controles de stock e inventario.
Mejora los tiempos de despacho y recepción.
Permite controlar la distribución de los productos a través de toda la cadena de comercialización.
El cliente recibe medicación con legitimidad, calidad, eficacia, seguridad garantizada y comprobada.
Reduce costos logísticos ya que detecta falencias previo al envío del producto.
Tecnologías de identificación soportadas
RFID

CÓDIGO DE BARRAS LINEAL

DATAMATRIX

Solución de Verificación de Medicamentos y Productos Médicos
para regulaciones vigentes de serialización y trazabilidad a nivel internacional
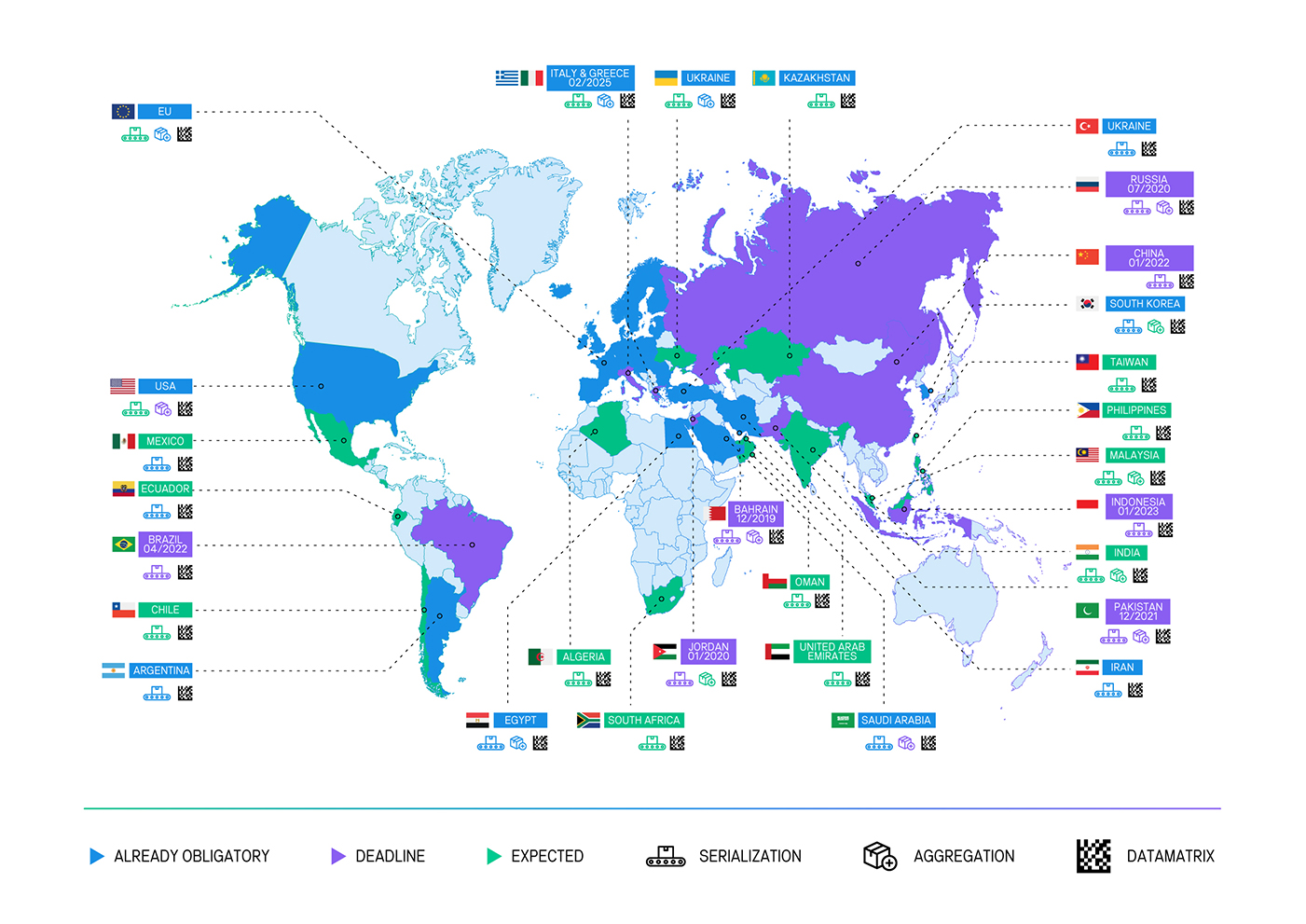
 UE
UE
Agencia gubernamental: regulado a nivel de país, guiado por la Organización Europea de Verificación de Medicamentos (EMVO).
Normativa: Falsified Medicines Directive (FMD) / Delegated Act on safety features.
Alcance regulatorio: serialización, informe y verificación de productos.
Alcance de productos: la mayoría de los productos farmacéuticos.
Participantes: todos.
Plazos: febrero de 2019.
Codificación: Estándar GS1.
Reporte: los fabricantes deben informar al Centralizador Europeo (European Hub).
Estado: en marcha.
 Argentina
Argentina
Agencia gubernamental: regulado a nivel de país, guiado por el Sistema Nacional de Trazabilidad de la ANMAT.
Normativa: Resolución 435/2011
Alcance regulatorio: Identificación individual y unívoca, verificación, seguimiento y reportes.
Alcance de productos: listado de medicamentos ANMAT.
Participantes: todos.
Plazos: desde el 2011.
Codificación: Estándar GS1.
Reporte: Todos los movimientos deben ser reportados Anmat.
Estado: en marcha.
 Brasil
Brasil
Agencia gubernamental: Ley 13.410/16. Regulado a nivel país por la Agencia Nacional de Vigilancia Sanitaria (ANVISA) a través del Sistema Nacional de Control de Drogas.
Alcance regulatorio: serialización, reportes y verificación.
Alcance de productos: productos farmacéuticos, dentales y veterinarios.
Participantes: todos.
Plazos: abril 2022.
Codificación: Estándar GS1.
Reporte: Todos los movimientos deben ser reportados a Anvisa.
Estado: en marcha.
 Ecuador
Ecuador
Agencia gubernamental: ARCSA, Agencia Nacional de Regulación, Control y Vigilancia Sanitaria.
Normativa: Resolución ARCSA-DE-013-2020-MAFG
Alcance regulatorio: Identificación individual y unívoca, verificación, seguimiento y reportes.
Alcance de productos: Resolución ARCSA-DE-013-2020-MAFG
Participantes: Medicamentos, productos biológicos y dispositivos médicos.
Plazos: 6 meses + fases.
Codificación: Estándar GS1.
Reporte: fabricantes reportan a la ARCSA, Agencia Nacional de Regulación, Control y Vigilancia Sanitaria.
Estado: normativa expedida.
 Rusia
Rusia
Agencia gubernamental: organización público-privada CRPT
Estado: En marcha. El experimento se viene llevando a cabo desde febrero del 2019.
 China
China
Agencia gubernamental: CFDA (China Food and Drug Administration).
Normativa: Mandatory coding for EDL (Essential Drug List) products.
Alcance de la regulación: serialización e informe.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores mayoristas y farmacias.
Plazo: 31/12/2015, para todos los medicamentos.
Codificación: el gobierno creó una codificación de 20 dígitos EDMC (Electronic Drug Monitoring Code).
Estado: suspendido temporariamente.
 Estados Unidos
Estados Unidos
Agencia gubernamental: FDA (Food and Drug Administration).
Normativa: Drug Supply Chain Security Act (DSCSA).
Alcance regulatorio: serialización, seguimiento y verificación.
Alcance de productos: la mayoría de los productos farmacéuticos.
Participantes: fabricantes, distribuidores, dispensadores (farmacias, hospitales).
Plazos: 7/2015 para dispensadores, 11/2017 para los fabricantes.
Estado: en marcha.
 India
India
Agencia gubernamental: DGFT (Directorate General of Foreign Trade (DGFT).
Alcance regulatorio: códigos de barra y serialización, agregación e informes.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores y dispensadores (farmacias y hospitales).
Plazos: marzo de 2016 o 2017, dependiendo de la clasificación de cada compañía.
Codificación: Estándar GS1.
Reporte: presentación de informes al portal de DAVA (Drugs Authentication and Verification Application).
Estado: en marcha.
 Corea del Sur
Corea del Sur
Agencia gubernamental: KFDA (Korea Food and Drug Administration).
Alcance regulatorio: serialización.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, importadores, distribuidores mayoristas.
Plazo: julio 2016 (para fabricantes).
Codificación: Estándar GS1.
Reporte: requisito de informes para los fabricantes en 2016, y 2017 para los distribuidores mayoristas.
 Turquía
Turquía
Agencia gubernamental: ITS (Turkish Pharmaceutical Track and Trace System).
Normativa: Amending Regulation Regarding The Packaging and Labelling Of Medicinal Products For Human Use.
Alcance regulatorio: serialización e informe.
Alcance de productos: todos los productos farmacéuticos.
Participantes: fabricantes, distribuidores mayoristas, dispensadores.
Plazos: no hay plazos adicionales previstos (implementado).
Codificación: Estándar GS1.
Reporte: todos los miembros de la cadena de distribución informan al ITS.
Estado: en marcha.
Contacto
España
Avenida de Europa 19, 3A. Alcobendas, Madrid, 28108
+34 910 601 552
Argentina
Italia 415, 1°, Vicente López
+54011 5263-9757
Brasil
Avenida Paulista, 2073 Horsa II Cj.1702
+55 11 91307-6193
Ecuador
Teresa de Cepeda N34-260 y Av. de la República
Email: info@verifarma.com
Si quiere trabajar con nosotros, escríbanos a info@verifarma.com
